拟南芥B-BOX32与CONSTANS-LIKE3相互作用调控开花
原文作者:Prateek Tripathia, Marcela Carvallob,1, Elizabeth E Hamiltonb,2, Sasha Preussc, and Steve A. Kaya,3
单位:aDepartment of Neurology, University of Southern California, Los Angeles, CA 90089; bDivision of Biological Sciences, University of California, San Diego, La Jolla, CA 92093; and cMonsanto Company, St. Louis, MO 63167
摘要:植物能够通过监测日长用开始开花来应对季节性环境变化。从营养期到繁殖期的过渡是开花植物的关键发育转变,以确保最佳的适应性和/或产量。此前有报道称,B-BOX32(BBX32)在大豆中异位表达时具有提高籽粒产量的潜力。在本研究中,我们对拟南芥B-box结构域基因BBX32进行了详细的分子表征。我们发现拟南芥的生物时钟调节BBX32并在清晨表达。为了了解BBX32调控的分子机制,我们进行了大规模的酵母双杂交筛选,并确定CONSTANS-LIKE 3(COL3)/BBX4是其相互作用的蛋白质伙伴之一。通过使用不同的遗传和生化测定,我们已经验证了这种相互作用,并表明在BBX32存在下,COL3以FT为靶点调节开花途径。基于这些发现,我们假设这个BBX32-COL3模块可能是影响拟南芥生殖发育的额外调节机制,可以转化到作物中以提高农业生产力。
关键词:BBX32; 开花; 康斯坦类; 拟南芥; 昼夜节律
意义:时钟基因已被证明在调节许多关键的农艺性状方面很重要。因此,在这个相互关联的时钟网络中识别新的参与者将为开发新的作物品种提供新的策略。我们的研究确定CONSTANS-LIKE 3(COL3)是拟南芥B-BOX32(BBX32)作用的关键蛋白结合伴侣。与COL3相互作用的发现为BBX32如何发挥其对生长和产量的影响提供了分子线索。它还将COL3视为不可或缺的蛋白结合伴侣,可与BBX32结合使用以提高生产率。这种调节途径可以作为作物遗传操作的有效策略,以提高农业生产力。
许多生物体通过整合日长和生长发育信息来为季节变化做准备。因此,为了在面对季节变化和地理限制时能茁壮成长,拥有一种强大的日长测量机制对植物来说是一种适应性优势。例如,在农业中,过早开花会影响植物的整体适应性,这可能会导致严重的下游事件,从而导致作物产量下降。通过对模式植物拟南芥中不同生理和遗传表型的研究,已经阐明了开花的机制[1-3]。植物如何通过感知光周期、光质量和信号通路网络的进一步协调来感知季节性变化的机制,已经清楚地概述了[1,3-6]。拟南芥,一种兼性长日植物,在长日开花比短日更早,与生物钟和光周期相协调[7-10]。日长测量的分子机制包括对CONSTANS(CO)基因表达的昼夜调节和对CO蛋白稳定性和活性的光调节[11]。在长日中表达的开花位点FLOWERING LOCUS T(FT)蛋白充当花的整合剂,通过韧皮部将信号从光敏叶片传递到芽尖分生组织(SAM),在那里开始开花[3,11]。然而,这个过程只发生在长日的条件下,当循环DOF因子1和2(CDF1和CDF2)对CO的抑制得到缓解时。这种去抑制主要由时钟调节蛋白GIGANTEA(GI)和黄素结合蛋白KELCH REPEAT F-BOX1(FKF1)的相互作用介导;GI和FKF1在长日结束时形成光依赖性复合物,并通过多泛素化将CDFs靶向蛋白酶体[10]。CO及其相互作用的伙伴,如ASYMMETRIC LEAVES 1(AS1)通过C端CCT[CO,CONSTANS-LIKE(COL)和TIMING OF CAB EXPRESSION1(TOC1)]结构域结合到FT启动子[12,13]。EAT1(TOE1)蛋白的靶标与CO结合位点附近的FT启动子结合,导致早晨CO活性降低。TOE1在下午与FKF1相互作用,竞争性地干扰FKF1-CO相互作用并稳定CO[11]。综上所述,这些结果表明,CO可能在一天中的不同时间通过不同的调节机制诱导FT表达,从而调控光周期开花。CO-FT模块在不同的作物物种,如水稻、大麦、玉米、西红柿、向日葵和甜菜)中具有高度保守性,具有不同的作用模式[3]。然而,CO-FT作用的机制在短日内有所不同[3]。据报道,温度和地理位置也会影响光周期开花途径,从而影响季节性开花[3]。因此,地理和环境线索的整合使得整个光周期开花调控框架变得复杂。
在拟南芥中,锌指转录因子(TFs)约占总基因组的15%,并在植物生长和发育中起关键作用[14,15]。B-BOX(BBX)家族成员是包含32个家族成员的锌指TFs。TF家族根据一个或两个参与蛋白质-蛋白质相互作用的B-BOX基序以及CCT结构域的存在与否分为五组(I-V)[15]。BBX蛋白存在于藻类、苔藓、动物和植物中,并且功能多样[15,16]。B-box家族成员的创始人和最具特色的成员是CO。研究报告称,BBX家族的其他成员,如COL3/BBX4,BBX6,BBX7(COL9),BBX19,BBX24/SALT TOLERANCE(STO),微蛋白1a(MiP1a)/BBX31和BBX32/EMBRYONGIC FLOWER-1 INTERACTING PROTEIN6(EIP6)也以不同的机制影响开花[17-22]。
有人提出BBX32可能在大豆中光和生物钟的界面上起关键作用[23]。有趣的是,拟南芥BBX32的过表达已被证明可以显着提高大豆的谷物产量[23],这暗示了该TFs家族在植物生殖适应性中的作用。在本研究中,我们剖析了BBX32在拟南芥中作用的分子机制。我们表明BBX32受生物钟调节,调节开花和下胚轴生长,并直接与COL3相互作用。我们提供了各种支持遗传和生化证据来建立这种相互作用,并证明FT是COL3的直接靶标。因此,本研究提出了BBX32在开花途径中的作用和可能的作用机制。
结果
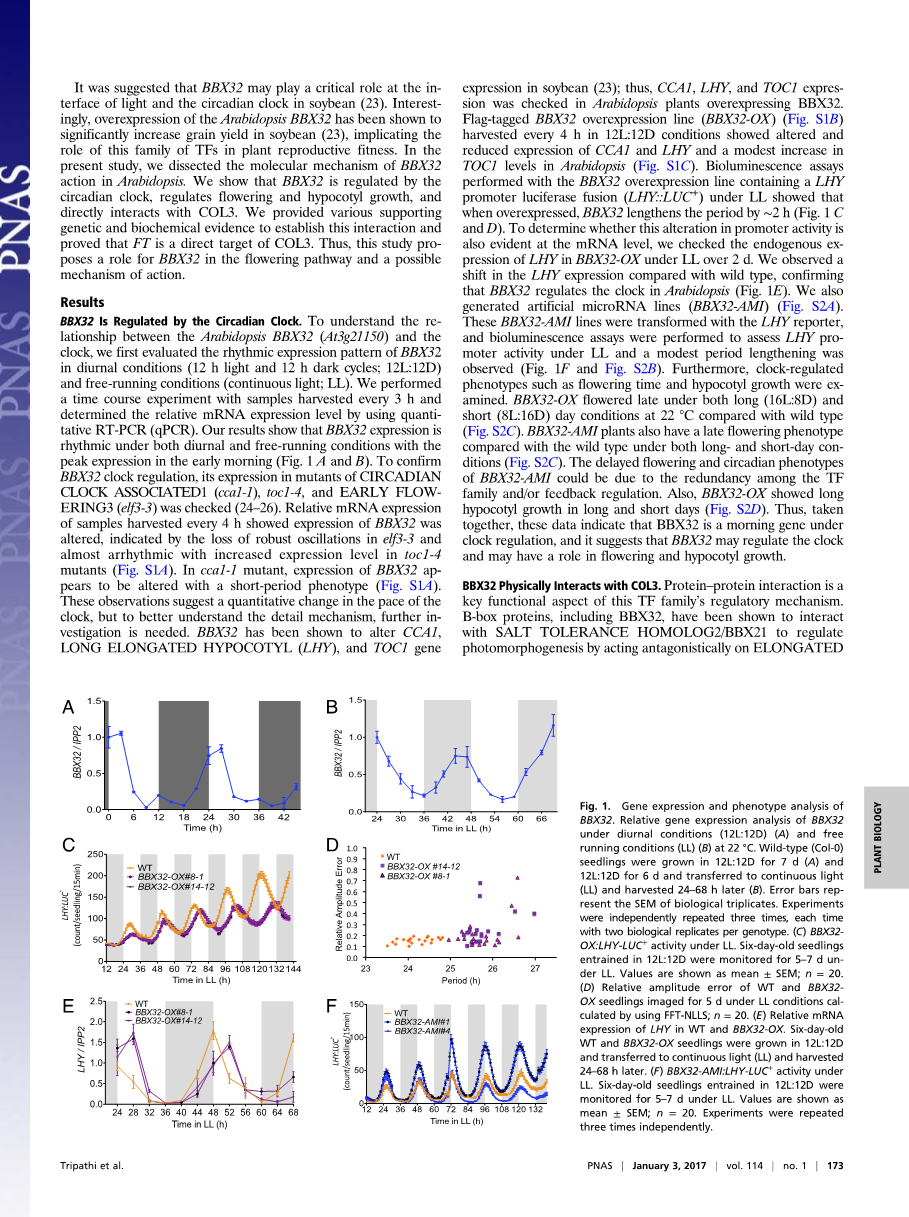
BBX32由生物钟调节。为了了解拟南芥BBX32(At3g21150)与生物钟的关系,我们首先评估了BBX32在昼夜条件下(12小时光照和12小时黑暗循环;12L;12D)和自由运行条件下(连续光;LL)的节律性表达模式。我们对每3小时收获的样品进行了时间过程实验,并使用定量RT-PCR(qPCR)测定了相对mRNA表达水平。结果表明,BBX32的表达在昼夜和自由成长条件下均有节律,并在清晨表达达到峰值(图1 A和B)。为了证实BBX32时钟的调节,检查了其在CIRCADIAN CLOCK ASSOCIATED1(cca1-1),toc1-4和EARLY FLOWERING3(elf3-3)突变体中的表达[24-26]。每4小时收获的样品的相对mRNA表达显示BBX32的表达被改变,表明elf3-3中失去了稳健的振荡,并且随着toc1-4突变体中表达水平的增加而几乎无节律(图S1A)。在cca1-1突变体中,BBX32的表达似乎随着短周期表型而改变(图S1A)。这些观察表明生物钟速度发生了数量变化,但为了更好地理解细节机制,需要进一步研究。BBX32已被证明可以改变大豆中的CCA1,细长下胚轴(LHY)和TOC1基因表达[23];因此,检查了过表达BBX32的拟南芥植株中CCA1、LHY和TOC1的表达。标记有标志的BBX32过表达品系(BBX32-OX)(图S1B)在12L:12D条件下每4小时收获一次,显示CCA1和LHY的表达改变和降低,拟南芥TOC1表达水平适度增加(图S1C)。在LL下使用含有LHY启动子荧光素酶融合(LHY::LUC )的BBX32过表达品系进行的生物发光测定表明,当过度表达时,BBX32将周期延长了约2个小时(图1 C和D)。为了确定启动子活性的这种改变在mRNA水平上是否也很明显,我们检查了LL作用下BBX32-OX中LHY的内源性表达超过2天。与野生型相比,我们观察到LHY表达的变化,证实BBX32调节拟南芥中的生物钟(图1E)。我们还生成了人工microRNA系(BBX32-AMI)(图S2A)。用LHY报告基因转化这些BBX32-AMI品系,并进行生物发光测定以评估LL下的LHY启动子活性,并观察到适度的周期延长(图1F和图S2B)。此外,还检查了生物钟调节的表型,如开花时间和下胚轴生长。与野生型相比,BBX32-OX在22℃的长(16L:8D)和短(8L:16D)日照条件下开花较晚(图S2C)。与野生型相比,BBX32-AMI植物在长日和短日条件下也具有晚花表型(图S2C)。BBX32-AMI的延迟开花和昼夜节律表型可能是由于TF家族和/或反馈调节之间的冗余。此外,BBX32-OX在长日和短日下显示出长的下胚轴生长(图S2D)。因此,这些数据共同表明BBX32是生物钟调节下的早晨基因,并且表明BBX32可以调节生物钟,并且可能在开花和下胚轴生长中起作用。
图1 BBX32的基因表达及表型分析。BBX32在22℃昼夜条件(12L:12D)(A)和自由运行条件(LL)(B)下的相对基因表达分析。野生型(Col-0)幼苗在12L:12D中生长7天(A)和12L:12D生长6天,并转移到连续光照(LL)并在24-68h后收获(B)。误差线表示生物三重体的SEM。实验独立重复三次,每次每个基因型有两个生物学重复。(C)在LL下BBX32-OX:LHY-LUC 的活性。6日龄幼苗在LL下12L:12D中监测5~7天。数值显示为平均值plusmn;SEM;n=20。(D)使用FFT-NLLS计算的LL条件下5天成像WT和BBX32-OX幼苗的相对振幅误差;n=20。(E)LHY在WT和BBX32-OX中的相对mRNA表达。将6日龄的WT和BBX32-OX幼苗以12L:12D培养,并转移到连续光照(LL)中,并在24~68h后收获。(F)在LL下BBX32-AMI:LHY-LUC 的活性。6日龄幼苗在LL下12L:12D中监测5~7天。数值显示为平均值plusmn;SEM;n=20。实验独立重复三次。
BBX32与COL3进行物理交互。蛋白质-蛋白质相互作用是该TF家族调节机制的关键功能方面。B-box蛋白,包括BBX32,已被证明与SALT TOLERANCE HOMOLOG2/BBX21相互作用,通过拮抗作用于ELONGATED HYPOCOTYL5(HY5)来调节光形态发生[27]。为了更深入地了解BBX32的分子功能,我们以BBX32作为诱饵(数据集S1)进行了高通量酵母双杂交(Y2H)筛选。在我们的Y2H屏幕中,一个有前途的交互器是COL3(At2g24790)。进一步的分析证实,C
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597863],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 溴氰菊酯对沼泽蛙的组织病理学和基因毒性作用外文翻译资料
- 面向DNA适配体生成的不对称PCR优化流水线的开发:初学者指南外文翻译资料
- 氧化石墨烯辅助分离的SELEX技术筛选磺胺喹喔啉的DNA适配体及其应用外文翻译资料
- 酶和微生物技术外文翻译资料
- 拟南芥B-BOX32与CONSTANS-LIKE3相互作用调控开花外文翻译资料
- 通过Kaiso对DLG1进行表观遗传调控,改变有丝分裂纺锤体极性,促进肠道肿瘤的发生外文翻译资料
- SON 通过调节 PTBP1/PTBP2 转换和 RBFOX2 活性驱动胶质母细胞瘤中的致癌 RNA 剪接外文翻译资料
- 水稻NAC转录因子ONAC066是干旱和氧化应激反应的积极调节因子外文翻译资料
- 重金属毒性的目标因素及其分子机理——镉毒性研究中的转录因子及下游基因外文翻译资料
- 中国古代莲——植物化学及治疗性概述外文翻译资料


